HPV - Papiloma vírus humano
Introdução
Definição
Os Human PapillomaVirus (HPV) são virús de acido desoxirribonucleico (ADN), que infetam superfícies mucosas e pele.(1)
Os genótipos de baixo risco (HPV 6, 11, 40, 42, 44) podem estar associados ao desenvolvimento de condilomas e de lesões intra-epiteliais de baixo grau, enquanto genótipos de alto risco (HPV 16, 18, 31, 33, 35, 45, 56 e 58) têm subjacente potencial carcinogénico, podendo ser causa de cancro do colo do útero, vagina, vulva, canal anal, pénis e orofaringe. (1,2)
Epidemiologia
Infeções cutâneas por HPV são frequentes e de fácil transmissão. Na população pediátrica prevalecem as lesões benignas.
As infeções por HPV são as mais comuns entre as sexualmente transmitidas. A sua incidência aumenta após a coitarca. (1,2) Aproximadamente 80% das mulheres adquirem HPV por contacto pele a pele (sem necessariamente coito) ou via genital-oral. Estima-se que após 11 atos sexuais, 100% dos tipos de HPV serão transmitidos ao parceiro, sendo reconhecida uma maior facilidade de transmissão entre sexo feminino/masculino que o oposto.
As infeções no sexo masculino são geralmente transitórias e superficiais, o que faz com que não se desenvolva uma resposta imune adequada, sendo por isso frequentes as reinfeções. Tal justifica que nas mulheres, a prevalência de infeção diminua com idade e que nos homens, permaneça elevada ao longo dos diferentes estratos etários. (1)
Pouco se sabe sobre infeção genital por HPV em crianças pré-púberes ou adolescentes sem vida sexual. Estão descritas diferentes formas de transmissão, nomeadamente a vertical, a auto ou heteroinoculação e a indireta via fómites.
São vários os estudos que demonstram que o HPV pode ser adquirido no período neonatal e que pode persistir ao longo de pelo menos 26 meses. Estas formas de transmissão não sexual representam um verdadeiro desafio clínico. (1)
História Clínica
História clínica
Os epitélios são geralmente infetados pelo HPV através de pequenas soluções de continuidade que permitem a entrada e o acesso às células da camada basal. As células metaplásicas da junção escamo-colunar do colo do útero e da orofaringe são locais de maior suscetibilidade. (1)
São reconhecidas 7 fases no ciclo de vida deste vírus: (1) adsorção; (2) entrada; (3) desnudamento, (4) transcrição e tradução, (5) replicação do genoma, (6) montagem e (7) libertação.
Numa primeira fase o vírus adere de forma específica a receptores presentes na membrana celular (mecanismo subjacente ao tropismo especifico). Entra no citoplasma por endocitose, liberta o seu material genético por processo de “desmontagem” do capsídeo e torna possível a transcrição, tradução e replicação do genoma.
Numa fase inicial são expressas proteínas precoces (E1 e E2), as quais são suficientes para a manutenção de replicação transitória. O genoma viral permanece como um epissoma, alcançando a superfície celular à medida que as células basais terminam o seu processo de diferenciação escamosa. Para a formação das partículas virais (viriões) são fundamentais proteínas tardias (L1 e L2), sendo a infeção de células adjacentes possível, após morte e lise celular.
A perda de E2 durante a fase de integração do ADN viral no genoma do hospedeiro é o primeiro passo para a transformação. Perante tipos de HPV oncogénicos destacam-se as proteínas E6 e E7, as quais são responsáveis pela perda de controlo do ciclo celular (E6 inibe p53; E7 inibe pRB), levando à acumulação de erros genéticos irreparáveis e à imortalização celular, podendo progredir para lesões intra-epiteliais de alto grau ou mesmo neoplasia.
Estima-se que o ciclo de vida tenha uma duração de 2 a 3 semanas, sendo que o período de incubação pode oscilar entre 1 a 20 meses de duração.
É possível que estas infeções permaneçam latentes a nível da camada basal, podendo ser reativadas em casos de imunossupressão mediada por células. A grande maioria das infeções são transitórias, pois 70 a 90% das adolescentes e populações não imunocomprometidas eliminam o vírus ao fim de 12 a 24 meses, mesmo com um tipo oncogénico.
Apesar de elevados níveis de infeção por HPV, a progressão para doença neoplásica não ocorre na sua maioria.
Assumindo que o vírus é considerado o principal agente causal na carcinogénese, estão descritas condições ou cofatores que aumentam o risco de persistência e progressão da infeção. A saber, infeção por tipos de HPV com potencial oncogénico, carga vírica elevada, paridade, imunossupressão ( imunocomprometidos podem sofrer progressão para lesão neoplásica em 5 a 10 anos, imunocompetentes levam 15 a 20 anos), tabagismo, coinfecção com outras doenças sexualmente transmissíveis (como Clamydia trachomatis) ou uso de contraceção hormonal superior a 5 anos consecutivos. (1,2)
Manifestações clínicas
A maioria das infeções por HPV são assintomáticas, no entanto, os achados clínicos podem ser variáveis de acordo com o epitélio afetado e o número de lesões.(1-3)
São várias as lesões associadas à infeção por HPV, sendo que a nível cutâneo as mais frequentes são as verrugas comuns, muito frequentes na infância. (2)
Os condilomas acuminados ou verrugas genitais podem ser identificadas ao longo de todo o períneo, mas também a nível vaginal, cervical ou no canal anal. (Figura 1) Podem ser assintomáticos ou manifestar-se sob a forma de prurido, ardor, dor ou hemorragia.
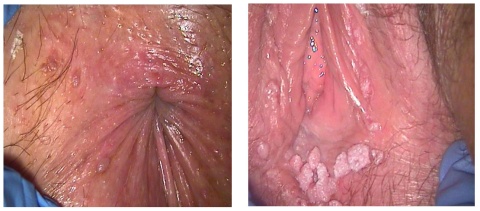
Figura 1 A e B: Condilomas acuminados. A) Lesões papulares não queratinizadas identificadas a nível perineal; B) Múltiplas lesões exofíticas queratinizadas, queratinizadas, tipo "couve-flor", presentes a nível do períneo e vulva (imagens cedidas pela Unidade de Patologia do Centro Hosp. do Algarve).
Os condilomas são lesões infeciosas, comuns na população sexualmente ativa e muito raros em crianças. Quando identificados na população pediátrica há que excluir a possibilidade de abusos sexuais. No entanto, a sua presença não é suficiente para a confirmação do contacto sexual, uma vez que a transmissão perinatal é reconhecida e estas lesões podem permanecer indetectáveis até uma fase tardia da idade da criança. (1) (Figura 2)
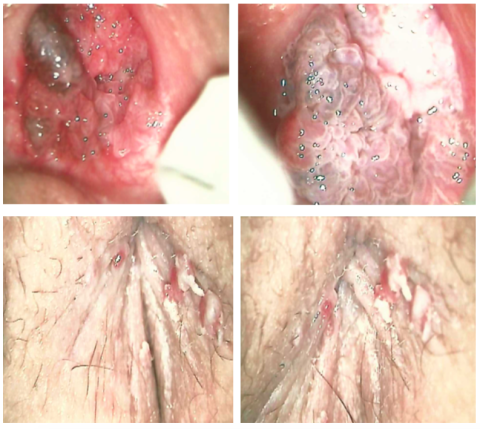
Figura 2: Condilomas acuminados. Criança com 8 anos de idade com condilomatose himeneal (hímen íntegro) e perineal exuberante. Identificado ADN-HPV 6 e 35 . Excluído abuso sexual (imagens cedidas pela Unidade de Patologia do Centro Hosp. do Algarve).
Aproximadamente 80 a 90% das lesões verrucosas estão relacionadas com HPV 6 e 11. (2)
A nível dos genitais externos podem ainda ser identificadas outro tipo de lesões relacionadas com HPV, embora raras, tais como a doença de Bowen, a papulose bowenoide, carcinomas espinhocelulares, tumor de Buschke-Löwenstein e neoplasias intra-epiteliais da vulva. (1)
Os HPV’s podem ainda provocar alterações celulares dando origem a neoplasias intraepiteliais de baixo ou alto grau, sendo que a nível do colo a maioria das lesões regride. Apesar do potencial evolutivo para cancro invasivo ser reconhecido, tal realidade não se adapta à população pediátrica ou adolescentes imunocompetentes, pois são lesões raramente identificadas em indivíduos não sexualmente ativos. (3)
Em adolescentes a maioria do ADN-HPV pode ser identificado sem que seja evidente qualquer tipo de lesão, representando no geral mera contaminação transitória. Em mulheres adultas a identificação de ADN-HPV está frequentemente relacionado com a presença de lesão.
Os genótipos 6 e 11 são igualmente responsáveis por 80 a 90% dos casos raros e graves de papilomatose laríngea recorrente. Ocorre geralmente após passagem pelo canal de parto de uma mãe infetada. (1,2)
Diagnóstico Diferencial
Perante a presença de lesões sugestivas de condilomas genitais há que diferenciar de outro tipo de alterações (1), tais como:
- Molluscum contagiosum: Infeção por poxvirús, contagiosa e frequente em crianças (Figura 3A);
- Condiloma latum (sífilis secundária): altamente infecioso. Lesão sob a forma de pápula ou pequena placa. A requisição de serologias facilita o diagnóstico;
- Protusão perineal piramidal infantil: lesão solitária perineal pediculada na linha média, anterior ao canal anal, frequente em meninas pré-puberes. Associada a resolução espontânea;
- Nevo epidérmico: lesão melânica ou hiperpigmentada, podendo ser identificado à nascença ou numa fase precoce da infância. Uma distribuição linear ou seguindo as linhas de Blaschko é sugestiva deste tipo de lesões; (Figura 3B)
- Outros: queratoses seborreicas.
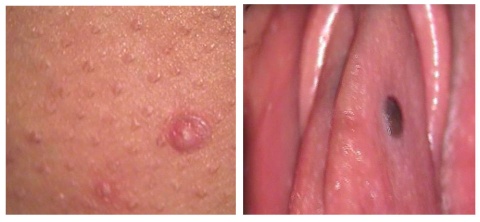
Figura 3 A e 3 B: A) Molluscum contagiosum, lesão papular, cor de pele e umbilicada. B) Nevo benigno, lesão hiperpigmentada de bordos regulares e superfície lisa, identificadaidentificada a nível do pequeno lábio esquerdo (imagens cedidas pela Unidade de Patologia do Centro Hosp. do Algarve).
Exames Complementares
O diagnóstico de verrugas é determinado por inspeção visual por um clínico com experiência, sem necessidade de testes adicionais. A confirmação histológica pode ser necessária perante dúvidas de diagnóstico ou suspeitas de malignidade: lesões atípicas, ulceradas, pigmentadas, fixas ou resistentes à terapêutica. (2)
A pesquisa de ADN viral não deve ser realizada em crianças, em jovens com menos de 25 anos ( segundo ASCCP- American Society for Colposcopy and Cervical Pathology, ACOG-American College of Obstetricians and Gynecologists, e as novas orientações para rastreio nacional do cancro do colo publicado em diário da república de Portugal em Setembro de 2017.
Segundo um estudo recente efetuado por Bacopoulou F. et al, quando avaliada a prevalência de ADN-HPV em adolescentes sexualmente ativas, virgens e crianças pré-puberes, 37,9% eram positivas, tendo sido identificados serotipos de alto risco em 47,4%, 28,6% e 24,1%, respetivamente. Segundo os autores, deverão estar subjacentes outras formas de transmissão que não apenas a sexual, mas concluem ainda que ao contrário de mulheres com 30 anos ou mais, a identificação de infeções HPV em adolescentes é fundamentalmente marcador de atividade sexual e não de risco para carcinoma do colo. (3)
Tratamento
A grande maioria das lesões verrucosas regridem espontaneamente, sendo que o tratamento fica reservado para doentes sintomáticas, assintomáticas mas com lesões persistentes (duração superior a 2 anos), imunodeprimidas ou ainda por motivos estéticos ou ansiolíticos. (1-2)
Previamente a qualquer tratamento, o médico deve reforçar o facto de se tratarem de lesões com recidiva frequente.
Os tratamentos disponíveis podem ser tópicos (destrutivos por agentes químicos, físicos, imunomodeladores ou excisionais) ou sistémicos. Podendo ser aplicados pelo doente/cuidador ou pelo médico assistente.
Perante a necessidade de tratar, a opção é fortemente influenciada pela tolerância da própria criança, logo o tratamento médico é de primeira linha.
1)Verrugas Genitais ou Condilomas Acuminados (1)
Em crianças, apenas foi testada a segurança e eficácia do imiquimod a 5% ou 3,75% e da podofilotoxina 0,5%.(Grau 2B de evidência).
| Fármaco: Imiquimod (Formulação creme a 5% ou 3,75%) | ||
| Administração | Eficácia | Efeitos Secundários |
|
- Imunomodulador - Creme a 5%: Aplicação tópica, 3 vezes por semana (dias não consecutivos) durante um máximo de 16 semanas, - Creme a 3,75%: Aplicação tópica, uma vez por dia, durante um máximo de 8 semanas. |
40-70% (Creme 5%) 28% (Creme3,75%) |
Eczema cutâneo |
| Fármaco: Podofilotoxina | ||
| Administração | Eficácia | Efeitos Secundários |
|
-Agente antimitótico -Formulação gel 0,5%: Aplicação tópica, 2 vezes ao dia, 3 dias consecutivos, num máximo de 4 semanas |
45-77% (Recidiva > ao Imiquimod) |
Irritação local, desconforto, Úlcera |
| Tratamento destrutivo e cirúrgico: Crioterapia, ablação por laser CO2 ou excisão cirúrgica | ||
|
Aplicação: - Lesões extensas ( > 1cm de diâmetro). - Lesões resistentes ao tratamento tópico |
||
|
- Aplicação sob anestesia - Riscos: Vulvodinia, hipoestesia ou alterações de pigmentação da pele - A recidiva é igualmente possível. |
||
A identificação de ADN-HPV não implica tratamento, pois pode ser representante de lesão transitória sem potencial evolutivo.(1-3)
Quando há desenvolvimento de lesões intra-epiteliais do colo em jovens o tratamento não é recomendado, sendo a prioridade uma atitude expectante, pois 90% resolvem ao fim de 1 a 2 anos. (1-4)
Vide tratamento Verrugas vulgares e Plantares e Papilomatose laríngea Recorrente
Evolução
50% das verrugas recidivam, sendo a opção correta repetir o mesmo tratamento e não conjugar outros, pois o risco de complicações é maior.
Existem poucos casos descritos de neoplasias genitais por infeções HPV em crianças. Em adolescentes sexualmente ativas é possível identificar lesões de alto grau, que na sua maioria regridem sem deixar sequelas.
Atualmente não existem dados suficientes que comprovem que uma criança exposta a infeção por HPV de alto risco, possa vir a desenvolver um cancro enquanto adulto. (1)
Recomendações
A única forma de prevenir uma infeção por HPV é evitar o contacto direto, no entanto, sendo teoricamente uma medida de aparente simplicidade, na prática a sua implementação é um verdadeiro desafio.
A grande morbilidade e receio subjacente às infecções por HPV tem na base o risco oncogénico. De acordo com dados da Centers for Disease Control and Prevention (CDC), mais de 90% dos cancros do colo do útero têm subjacente uma infeção persistente por HPV de alto risco (70% dos carcinomas escamosos e 90% dos adenocarcinomas estão relacionados com os tipos 16 e 18). No entanto, é ainda reconhecido o papel de HPV de alto risco em 90% dos carcinomas anais, 70% dos carcinomas da vagina e vulva e em mais de 60% dos cancros do pénis e da orofaringe. O risco de desenvolvimento aumenta com a idade, atingindo um pico entre os 35 e os 55 anos. (2)
Muito se tem estudado relativamente a mecanismos de carcinogénese e identificação de fatores de risco, com o intuito de implementar medidas preventivas. Apesar da grande diminuição da incidência do carcinoma do colo do útero ter na base medidas de prevenção secundária, ou seja, rastreio sob a forma de citologia do colo do útero e/ou HPV, as medidas de prevenção primária são fundamentais.
Atualmente são reconhecidas formas de prevenção primária, tais como a circuncisão (diminui a prevalência de infeção HPV), o adiamento da idade da coitarca, o uso de preservativo (que não protege na totalidade por não cobrir toda a área genital), número reduzido de parceiros, evicção de hábitos tabágicos entre outros de índole comportamental.
No entanto, a grande revolução deve-se ao desenvolvimento e implementação de vacinas profiláticas. Foram desenvolvidas três vacinas: uma tetravalente tendo como alvo os serótipos HPV 6/11/16/18 (Gardasil®), uma bivalente direcionada contra HPV 16/18 (Cervarix®) e a última, mais recente nonavalente que abrange os serotipos da Gardasil® e ainda outros de alto risco, HPV 6/11/16/18/31/33/45/52/58 (Gardasil-9®).(4) Qualquer uma das vacinas é desprovida de material genético, não tendo por isso associação com risco infecioso ou oncogénico.
A imunogenecidade (desenvolvimento de anticorpos neutralizantes) é alcançada através da recombinação da proteína do capsídeo L1, a qual dá origem a diferentes partículas semelhantes aos vírus (Virus Like Particles- VLPs). Todas as vacinas alcançam níveis de imunogenecidade semelhante, logo, todas são seguras e eficazes.
Nos Estados Unidos da América, em Dezembro de 2010, a Food and Drugs Administration (FDA) aprovou o uso da vacina tetravalente na prevenção de lesões pré-malignas e malignas do ânus, tanto em rapazes como em raparigas, dos 9 aos 26 anos. A 25 de Outubro de 2011, o Advisory Committee on Immunization Practices (ACIP) recomendou que todos os rapazes de 11 e 12 anos fossem vacinados contra o HPV com a vacina tetravalente). Em Março de 2015 o comité europeu aprovou a Vacina Gardasil-9® (para mulheres e homens, a partir dos 9 anos de idade), como medida preventiva de verrugas genitais, de lesões pré-malignas e malignas do colo do útero, da vulva, da vagina ou do ânus. (4)
Em Outubro de 2008 a vacina Gardasil® passou a fazer parte integrante do plano nacional de vacinação (em Portugal), tendo sido administrada a meninas com 13 anos de idade (com repescagem de jovens com 17 anos durante os três anos iniciais). A partir de Janeiro de 2017 a vacina tetravalente foi substituída pela nonavalente, passando a ser administrada a meninas com 10 anos de idade em esquema de duas doses (0 e 6 meses). A partir de Outubro de 2020 a vacina nonavalente será estendida a meninos com 10 anos de idade no mesmo esquema já realizado em raparigas e com repescagem de todos aqueles nascidos em 2009.
Estudos prevêem que a vacinação de uma população “HPV-naive” conduza a uma redução de 50% na prevalência de lesões de alto grau e 70% de cancro do colo do útero, sendo por isto vista como uma medida de grande eficácia e com impacto real na doença. Dados australianos demonstram que em 4 anos de implementação da vacina, houve um decréscimo considerável de condilomas genitais.(1) Apesar da duração da proteção fornecida ser ainda alvo de estudo, dados recentes da CDC afirmam que durante 8 a 10 anos de seguimento, não houve redução da mesma.
Antecedentes de alterações citológicas, condilomas ou outras infecções por HPV não contraindicam a vacinação. A eficácia esperada não é a mesma que perante ausência de contacto prévio, no entanto, esta medida é considerada como custo-eficaz em termos individuais, não havendo por isso limite de idade. Nesta população são ainda aconselhadas as três doses da vacina. (1,4)
Apesar das propriedades profiláticas inerentes às vacinas, estas apenas conferem proteção contra os serótipos que incluem, (estando descrita proteção cruzada de 20% para outros de alto risco nas vacinas bivalente e tetravalente), e não possuem qualquer efeito terapêutico. (1,4)
Atendendo ao exposto, há que reforçar a importância da vacinação previamente a qualquer contacto sexual. No entanto, uma vez que as vacinas não incluem todos os serótipos conhecidos e que muitas mulheres são vacinadas em fase pós-infeção, é mantida a necessidade de rastreio de cancro do colo útero. (5) Esta medida de prevenção secundária, efetuada atualmente por pesquisa de ADN de HPV de alto risco e triagem dos resultados positivos para HPV de alto risco, não 16 ou 18 por citologia do colo do útero, continua a desempenhar um papel fundamental na detecção precoce e no tratamento de lesões pré-neoplásicas e neoplásicas."
Estudos demonstram que o diagnóstico de cancro do colo do útero é extremamente raro em mulheres com menos de 20 anos e que entre os 20 e 24 anos não há qualquer impacto na incidência da doença. Assim sendo a Sociedade Portuguesa de Ginecologia - Secção Portuguesa de Colposcopia e Patologia Cervico-vulvovaginal, recomenda que o rastreio seja iniciado aos 25 anos (com periocidade de 5/5 anos). Alguns países europeus protelam o inicio para os 30 anos de idade (1,7). Curiosamente, um estudo demonstrou que os clínicos americanos continuam a manifestar receio em protelar o início do rastreio para os 21 anos, principalmente perante adolescentes com múltiplos parceiros sexuais ou grávidas. (5)
Estudos observacionais confirmam que os potencias beneficios do rastreio numa população adolescente são largamente ultrapassados pelos prejuizos que daí possam advir.
Existem no entanto exepções. Nas adolescentes portadoras do vírus da imunodeficiência humana (HIV), o risco de desenvolver lesão intraepitelial é 4 a 5 vezes superior a uma população HIV negativa e com comportamentos sexuais de risco. Deste modo, é aconselhado iniciar o rastreio no ano do diagnóstico ou um ano após a coitarca, mantendo uma periocidade anual.
A tipagem HPV não é recomendada antes dos 25 anos de idade. Em imunodeprimidas, a ACOG aconselha inicio de rastreio aos 21 anos, embora alguns autores iniciem um ano após a coitarca. Por fim, é igualmente preconizado rastreio citológico cervical e vaginal em jovens cujas mães tomaram dietilestilbestrol na gravidez, motivado pelo maior risco de cancro da vagina e do colo (independente do HPV).
Concluindo, é fundamental a adesão a medidas de prevenção primária (vacinação contra HPV e programas de educação para a saúde sexual) e posteriormente de prevenção secundária (rastreio do cancro do colo do útero).
Saber Mais
HPV(Human papillomavirus): Genótipos de baixo risco (HPV 6, 11, 40, 42, 44...); Genótipos de alto risco (HPV 16, 18, 31, 33, 35, 45, 56 e 58)
Bibliografia
- Kliegman et al; Nelson Textbook of Pediatrics, 20th ed; Elsevier; 2016
- Palefsky J.;Epidemiology of human papillomavirus infections; UpToDate [Internet]; [revisão Março 2016], disponível em: www.uptodate.com;
- Bacopoulou F. et al.; Genital HPV in Children and Adolescents: Does Sexual Activity Make a Difference? J Pediatr Adolesc Gynecol(2015) 1e6;
- Castle P. Et al ; Recommendations for the use of human papillomavirus vaccines; UpToDate [Internet]; [revisão Março 2016], disponível em: www.uptodate.com;
- Spiryda L.B. et al.; Mini Review: Delaying Pap Test screening in the adolescent population:An Evidence-Based Approach; J Pediatr Adolesc Gynecol 27 (2014) 3e5
Deseja sugerir alguma alteração para este tema?
Existe algum tema que queira ver na Pedipedia - Enciclopédia Online?


